サンフランシスコ--(BUSINESS WIRE)--(ビジネスワイヤ) -- アビオメッド(NASDAQ: ABMD)は、PROTECT III試験の結果を発表します。PROTECT IIIは、高リスクPCI患者でImpella 2.5およびImpella CPに対する市販後承認(PMA)を取得すべく進行中の前向き単群のFDA承認後試験で、PROTECT IIランダム化対照試験(RCT)に続くものです。
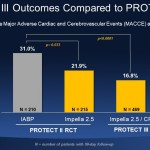

PROTECT IIIは、ImpellaによるプロテクテッドPCIの90日目で、死亡、脳卒中、心筋梗塞、再手術の主要評価項目が、PROTECT IIとの比較で低減することを示しました。死亡、脳卒中、心筋梗塞、再手術は、まとめて主要心・脳血管有害事象(MACCE)として知られています。
患者898人を対象としたこの中間解析の結果は本日、第31回経カテーテル心血管治療学(TCT)会議にて、本研究の運営委員を務めたJeffrey J. Popma医師(MD)が発表しました。Popma医師はベス・イスラエル・ディーコネス・メディカル・センターのインターベンション心臓診療科長とハーバード医学大学院内科教授の役職にあります。
FDA臨床試験のPROTECTシリーズは、PROTECT I、PROTECT II RCT、PROTECT IIIを含み、血行力学的補助を受けた高リスクPCI患者を対象としたFDA試験として過去最大の規模を持つものです。同シリーズは、7月時点で1366人の患者を組み入れており、血行力学的補助を受けた高リスクPCI患者を対象に実施された唯一のFDAランダム化対照試験を含みます。
発表されたProtect IIIの試験結果
PROTECT IIIの患者は、PROTECT IIの患者と比較して、統計的に高齢(71歳)で、女性(26%)と非白人(33%)の割合が高く、循環補助を受けている期間が長い上に、治療された血管が多くより複雑な手術を受けていました。それにもかかわらず、PROTECT IIIにおける90日目のMACCE発生率は、PROTECT IIにおける大動脈内バルーンポンプ(IABP)の対照群より低いものでした。IABP群におけるMACCEの複合発生率は31%であったのに対し、Impella 2.5/Impella CP群は16.8%でした(p<0.0001)。
Popma医師は、次のように述べています。「PROTECT試験から得た知見に基づけば、PCI実施中に血行力学的補助を行うかどうかの判断は完全な血行再建を行うという観点で下すべきであり、患者転帰には入院中と退院後の改善を含めるべきです。完全な血行再建の達成が重要であることは過去の研究で示されていますが、その理由は不完全な血行再建と比較してMACCEを30~50%低減できるからです。」
急性腎障害(AKI)に関するデータの概要
高リスクPCI患者は、高い造影剤濃度と長時間の手術が原因でAKIのリスク上昇に直面します。さらに、慢性腎臓疾患は一般的な併存疾患です。患者98万5737人を対象としたNCDR Cath PCIレジストリー研究によれば、AKI患者の院内死亡率は10%で、透析が必要な場合は34%に上昇します。
PROTECT IIIでは、サブグループ(N=106)について急性腎障害(AKI)発生率の評価を行い、傾向スコアマッチングを行った対照群(N=106)と比較しました。結果はTCT会議の科学セッションで発表します。Impellaを使用した複数の研究では、造影剤の使用量を含め、予想されるAKIのリスク因子に基づきAKIの発生率が評価されました。これらの研究には次のものが含まれます。
Circulation誌(2012年) - PROTECT II RCT試験で、Impella使用群の患者は IABP群の患者よりも使用した造影剤の量が統計的に多かった(267 ml対241 ml、p=0.04)にもかかわらず、30日目および90日目における急性腎不全の発生率は数値的に低く(それぞれp=0.792およびp=0.776)、造影剤の量と腎不全の非連動性が判明しました。
Circulation Research誌(2017年) – Flahertyらは、Impellaを使用した場合、Impellaによる循環補助を使用しない場合と比較して、透析を必要とするAKIの発生率が6分の1に低減することを明らかにしました(p=0.031)。
Catherization and Cardiovascular Interventions誌(2019年) – Flahertyらは、予想された発生率(Mehranリスクスコアを使用)が22%であったところ、Impellaによる循環補助を受けた患者のわずか5%が48時間後にAKI(ステージ1のみ)を発症したことを発見しましたが、この割合はAKIリスクの77.6%低減に相当します(p<0.0001)。
PROTECTシリーズについて
PROTECT III試験には、2017年3月から2019年7月にかけて、米国の45施設で組み入れた患者898人が参加しています。PROTECTシリーズは現在、参加患者数が 1366人に及んでおり、ImpellaはFDA史上で最も研究された機械的循環補助デバイスとなっています。
ヘンリー・フォード病院の構造的心疾患センターでメディカルディレクターを務めるウィリアム・オニール医師(MD)は、次のように述べています。「Impellaによる循環補助下の高リスクPCIを支持する臨床データ全体により、インターベンショナル心臓医は、最適な治療法と技術を使用しており、1回のセッティングで完全な血行再建を達成し、処置における血行動態の安定性を向上させ、患者の生活の質を改善する上で役立っているという自信を持つことができます。」
アビオメッドはPROTECTシリーズの試験を、2006年のPROTECT Iを皮切りに開始し、2007年から2010年にかけてPROTECT II RCTを実施しました。アビオメッドは2009年にImpella Quality(IQ)データベースを創成し、現在では患者10万人以上の実臨床データを収集しています。
FDAはPROTECT I(N=20)、PROTECT II RCT(N=448)、レジストリーデータの結果に基づき、高リスクPCIを適応とする機器としては初めて、最高水準の安全性と有効性の承認となる市販後承認(PMA)をImpellaに与えました。Impellaは、8件の臨床ガイドラインと、550本以上の査読付き論文に掲載されています。
PROTECT IIIの結果に関しPopma医師がコメントしているビデオと、TCTにおけるPopma医師の発表スライドがオンライン(www.ProtectIIIStudy.com)でご覧いただけます。TCTにおけるPopma医師の発表内容は、24時間以内にwww.ProtectIIIStudy.comに掲載されます。
本研究は、アビオメッドが臨床転帰を改善するというコミットメントの一環として後援しています。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの選択的で緊急の経皮的冠動脈インターベンション(PCI)を受ける一定の進行性心不全患者の治療を目的として、米国FDAより市販前承認(PMA)を取得しています。Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5™は、心原性ショックを呈する心臓発作/心筋症患者の治療に使用する心臓ポンプとして米国FDAの承認を取得しており、生来の心臓回復を可能にし、患者が自身の心臓のまま帰宅できるようにする独自の能力を備えています。Impella RP®は、左心補助人工心臓埋め込み、心筋梗塞、心臓移植、心臓切開手術の後の右心不全または代償不全の治療を目的として米FDAの承認を受けています。Impellaは、FDA史上で最も研究された機械的循環補助デバイスで、10万人以上の患者に関する実臨床データ、550本以上の査読付き論文が存在します。
欧州でImpella 2.5、Impella CP、SmartAssist搭載Impella CPは、高リスクPCIおよび急性心筋梗塞(AMI)の心原性ショック患者の5日目までの治療を目的としてCEマークを取得しています。Impella 5.0およびImpella LDは、心原性ショックを呈する心臓発作/心筋症患者の10日目までの治療を目的としてCEマークを取得しています。Smart Assist®搭載Impella 5.5™心臓ポンプは、心原性ショックを呈する心臓発作/心筋症患者の30日目までの治療を目的としてCEマークを取得しています。Impella RPは、左心補助人工心臓埋め込み、心筋梗塞、心臓移植、心臓切開手術、難治性心室性不整脈の後の右心不全または代償不全の治療を目的としてCEマークを取得しています。
承認された適応症や、デバイスの使用に伴う重要な安全性・リスク情報を含め、Impella心臓ポンププラットフォームの詳細については、www.impella.comをご覧ください。
アビオメッドについて
米マサチューセッツ州デンバーに拠点を置くアビオメッドは、循環補助用の医療機器を提供する一流企業です。当社製品は血流の改善もしくは心臓のポンプ機能の実行または両方により心臓を休止させるよう設計されています。詳細情報については、www.abiomed.comをご覧ください。
Abiomed、Impella、Impella 2.5、Impella 5.0、Impella LD、Impella CP、Impella RP、Impella Connectは、アビオメッドの登録商標で、米国および一定の外国で登録されています。Impella BTR、Impella 5.5、Impella ECP、CVAD Study、SmartAssistはアビオメッドが登録申請中の商標です。
将来見通しに関する記述
本リリースは、アビオメッドの既存製品および新製品の開発、商業的成長に向けた当社の進捗状況、将来の機会および期待される規制関連の承認に関する記述を含め、将来見通しに関する記述を含んでいます。当社の実際の成績は、多くの要因のため、これらの将来見通しに関する記述で予想された内容とは大きく異なる場合があります。それらの要因には、開発、試験、関連する規制上の承認に伴う不確実性(将来の損失の可能性を含む)、複雑な製造、高品質の要件、限られた供給源への依存、競争、技術の変化、政府の規制、訴訟関連の問題、将来の資金需要と追加資金調達の不確実性、最新のフォーム10-K年次報告およびフォーム10-Q四半期報告を含め、当社が米証券取引委員会に提出した書類で詳述したその他のリスクや問題が含まれます。これらの将来見通しに関する記述は、本リリースの日付時点での言及に過ぎず、過度の信頼を寄せないように注意をお願いします。当社は、これらの将来見通しに関する記述に対するいずれの訂正についても、その結果を公表する義務を負いません。これらの訂正は、本リリースの日付以降に発生する出来事や状況を反映させたり、予想外の出来事を反映させたりする場合に行われる可能性があります。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
Tom Langford
Director, Communications and Public Relations
978-882-8408
tlangford@abiomed.com
Ingrid Goldberg Ward
Director, Investor Relations
978-646-1590
igoldberg@abiomed.com
