米国のタフツ大学(Tufts University)の研究者らはヒト気管支上皮細胞を使って、自律的に動くバイオロボットを開発することに成功しました。
このバイオロボット(アンスロボット)は、直径30~500ミクロンの球状多細胞生物で繊毛による推進能力を備えています。
これまでのバイオロボットは、外部からの制御を必要とするものがほとんどでしたが、今回は細胞自体が自律的に組織化し、独自に運動するという全く新しいアプローチです。
私たちの体の血管内を動き回り、患部を治療する医療用バイオボットは、何年も前から構想はありましたが、現在のところまだ実用化には至っていません。
人間の体内では、微細な血管が迷路のように入り組んでおり、手術の際に大きな障壁となっています。
また、視覚では患部を確認することが困難であることから、的確な治療が行えないこともあります。
しかし、自律的に活動するロボットが、手術で到達が難しい部位にある血栓を溶かしたり、他の組織を傷つける恐れがあって到達できないような患部を処置したり、薬を注入したりできるのです。
このような医療用バイオロボットの実現は、医療革命を起こすかもしれません。
米国タフツ大学のアンスロボットに関する研究は『Advanced Science』誌に公開されています。
目次
- バイオロボットとは
- 自律的に組織化していくアンスロボット
- アンスロボットの行動特性、修復機能について
- 今後の展望
バイオロボットとは
この研究の主な目的は、ヒトの前駆細胞を使用して自己組織化する能力を持つバイオロボットを作り出し、さらにそれが自ら運動し、どう機能するかを検証することです。
以前開発されたバイオロボットである、ゼノボットはカエルの皮膚細胞と心筋細胞から作られ、手作業で成形する必要がありましたが、このバイオロボットは ヒト細胞由来であり、自律的に組織化して特有な機能を持つものです。
このような自己組織化の能力を持つバイオロボットは、損傷部位の修復や精密な薬物の運搬機能のような幅広い応用が期待されています。
従来のバイオロボット研究では、通常、合成材料や生体由来の細胞を組み合わせて、外部の制御装置に依存して運動させていました。
しかし、この研究では、完全に生体材料からなるロボットを作り、その動きが自己組織化された細胞間の相互作用によって生み出されるかを探求しています。
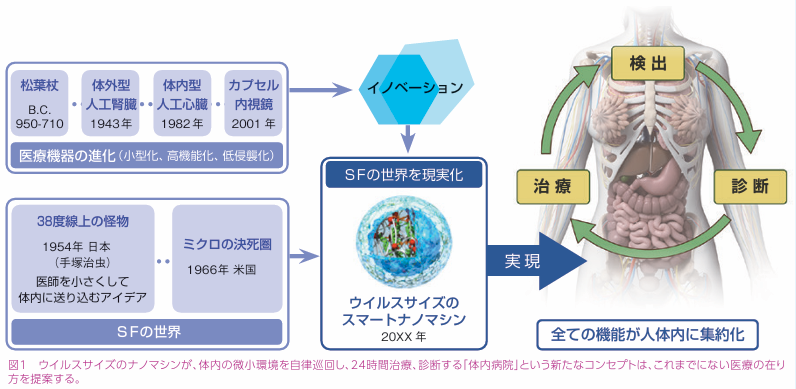
この試みでは、まるで20世紀ではSFの世界にしかなかった、微小なロボットが私たちの体内で自律的に巡回し、24時間診断、治療してくれるという「体内病院」の具体化の一歩になろうとしているのです。
タフツ大学が行った研究の基礎となる「前駆細胞」とは、成人の体細胞の一種で、特定の細胞種に分化する能力を持つ細胞です。
これらの細胞は通常、特定の組織の修復や再生に関与しており、骨、筋肉、皮膚などに分化する可能性があります。
今回の試験では、この細胞を「種細胞」として使用し、そこから自己組織化が起こるかどうかを試みています。
前駆細胞は、成人の体から簡便に採取できるため、将来的な医療応用においても非常に有望と考えられています
今回の試験では、前駆細胞として成人のドナーから提供された気管支上皮細胞が使われています。
これらの気管支上皮細胞は、通常、肺の中で繊毛(せんもう)と呼ばれる毛状の突起物で覆われており、繊毛を波打たせて気道に入った微小な異物を外に排出してくれます。
この繊毛は、特徴として治療や医療技術の一部として応用しやすいと共に、自律的に運動する能力や、傷ついた周囲の組織に対して修復や再生を行う能力を持っています。
これらの理由から、繊毛は今回の試験において重要な役割を果たしています。
試験手順は、以下の通りです。
研究チームは、まず気管支上皮細胞を特定の培養条件下で育て、その細胞がどのように自己組織化するかを観察しました。
このプロセスでは、細胞間の伝達機能を重視し、特定の信号や物理的な力が細胞の運動能力にどう影響するかを検証しています。
次に、気管支上皮細胞から筋肉組織に似た構造を作り、その構造が自発的に収縮、弛緩し、運動を行うかどうかを確認しました。
これには、細胞がどのようにして収縮、弛緩を行うか、その運動が周囲の環境に対してどのような影響を与えるかが重要なポイントとなります。
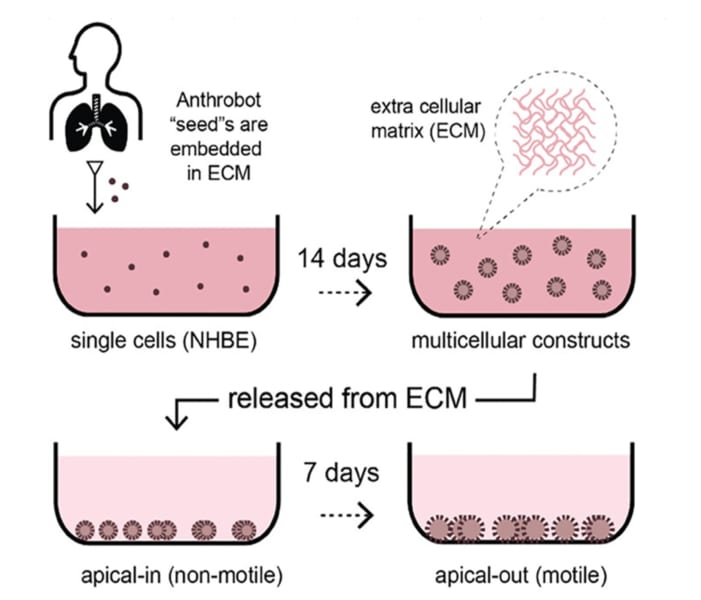
下図は、気管支上皮細胞が、多細胞で運動能力を持つ生体構造を自ら構築していくプロセスです。
通常、繊毛は細胞の表面に存在しますが、この試験では細胞の内面にある繊毛の配置を変えるために、粘性の低い培養環境下で細胞の表面に移動させようとしました。
以下が、気管支上皮細胞の内面にある繊毛が表面を向くように誘導するプロセスです。
まず繊毛のない球体を作り、細胞同士をつなぐネットワークである細胞外マトリックス(ECM)の中で14日間培養します。
このプロセスが14日間続いた後、成熟したスフェロイド(球状の細胞集合体)をECMから取り出し、粘性の低い環境に移してからレチノイン酸で細胞の分化を促進させ7日間培養します。
ようやく、7日目に細胞の表面に繊毛を持つ運動機能のある球体のスフェロイドが完成しました。
自律的に組織化していくアンスロボット
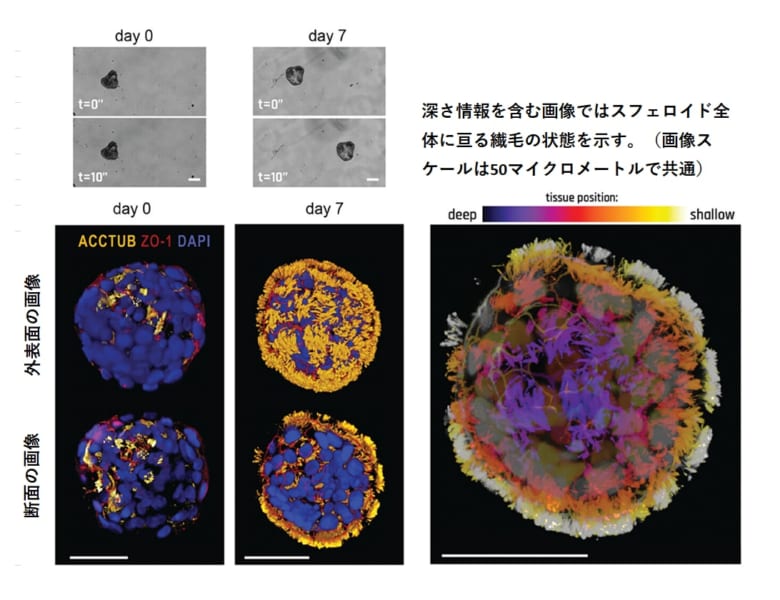
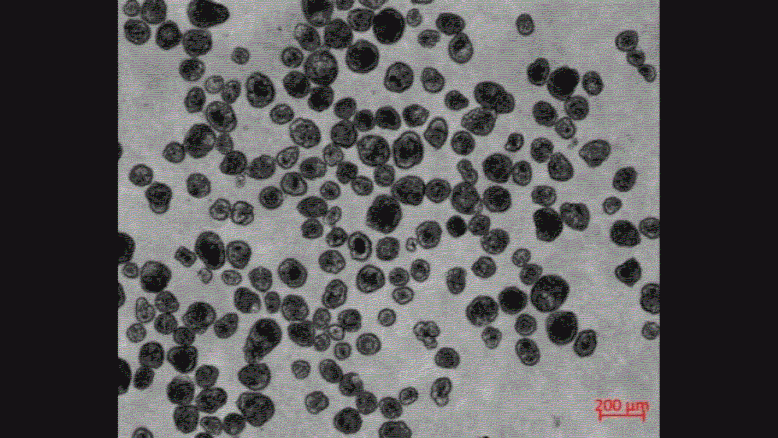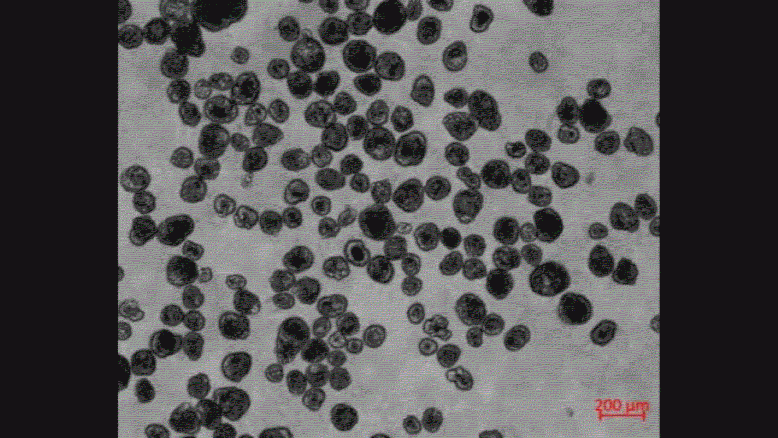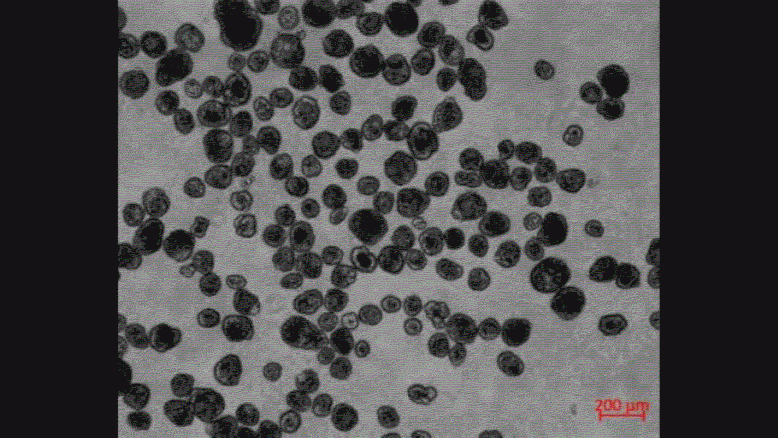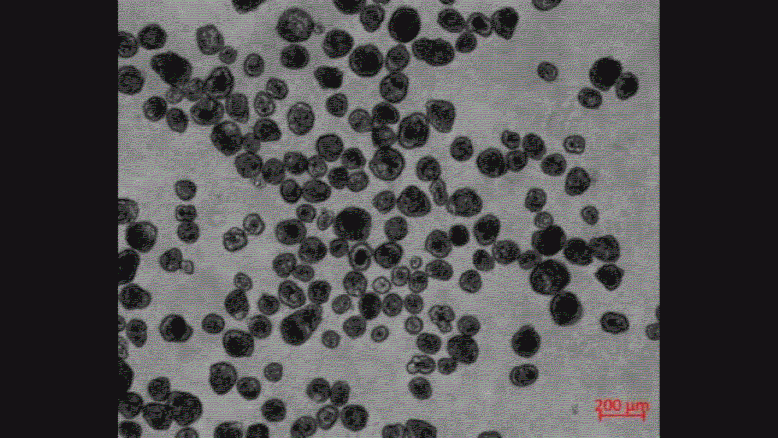
下図は、ECMから取り出した直後のスフェロイドと、取り出してから7日後のスフェロイドの画像です。
0日目のスフェロイドは運動性を示しませんが、7日目のスフェロイドは運動性が大幅に増加していました。
スフェロイドがECMから取り出された後の3週間で、全体で2281個のスフェロイドが観察されましたが、そのうち約50%はその大部分に繊毛があるにも関わらず、3週間の間に運動性を示しませんでした。
これらは「動かないスフェロイド」と分類されています。
下図のカラーの画像は、0日目と7日目のスフェロイドの染色結果です。
繊毛(黄色)、細胞間の結合状態(赤色)、および核(青色)の外表面と断面の様子が示されています。
7日目には、スフェロイド表面の繊毛(黄色)の量が大幅に増加しているのが分かります。
この繊毛は、運動を行うための大切な要素になっています。
繊毛が自己組織化して形成されることで、まるで生命を持ったかのように動く「生体構造」が完成されるのです。
この研究が示すのは、ヒトの細胞が自律的に構造を作り、さらに運動能力を発揮する驚異的なメカニズムです。
以下、「動くスフェロイド」をアンスロボットと呼びます。
下記の動画では活発に動き回る7日目のアンスロボットが確認できます。
アンスロボットの行動特性、修復機能について
この研究では、アンスロボットの形や動きについて調べています。
研究者たちは、350個のアンスロボットの3次元データを集め、その形や繊毛の配置について詳しく分析しました。
繊毛の配置としては、タイプ1(小さく形が滑らかで、球形に近い繊毛の分布)、タイプ2(形が不規則、繊毛が多くて全体的に均一に分布)、タイプ3(繊毛が特定の場所に集中して偏った分布)があり、全ての種類の形状についてはあまり変わらないことが分かっています。
アンスロボットの活動については、「動くもの」の中から「直線的に動くもの」と「円形に動くもの」各々をランダムに選び、各アンスロボットの左右対称性を比較しました。
結果としては、直線的に動くアンスロボット(その85%がタイプ2)は高い左右対称性を持ち、円形に動くアンスロボット(その88%がタイプ3)は左右対称性が低いことが確認されました。
後者は、タイプ3の形状から、繊毛の回転運動に偏りが生じて活動時に左右非対称性をもたらす可能性を示しています。
また、ヒトの神経細胞から作られた細胞層に幅400〜1,000ミクロンの傷を付け、その上をアンスロボットがどのように動くかを観察しました。
その結果、円運動をし、かつ動きが速いロボットの方が、直線的に動くロボットよりも傷の中でユニークな動きをし、傷全体を効果的に覆うことが分かりました。
この結果を踏まえ、アンスロボットが周囲の細胞にどのような影響を与えるのかを確認してみることにしました。
自然界では、個体が群れとして集合的に行動することで利益を生み出す「群知能」といった現象があります。
これに着想を得て、複数のアンスロボットが自然に集まって融合し、より大きな構造を形成する「スーパーロボット」を作ることにしました。
特別な型や機器を使わず、単に小さな皿の中に複数のアンスロボットを入れることで自発的に集まるようにしました。
これは、アリが体を繋げて橋を作り、広い隙間を渡る行動に似ています。
試験では、このスーパーロボットを傷ついた神経細胞層の隙間に配置し、彼らが左右の傷をまたいで「橋」のようにつなげて、傷ついた部分が修復されるかどうかを確認しました。
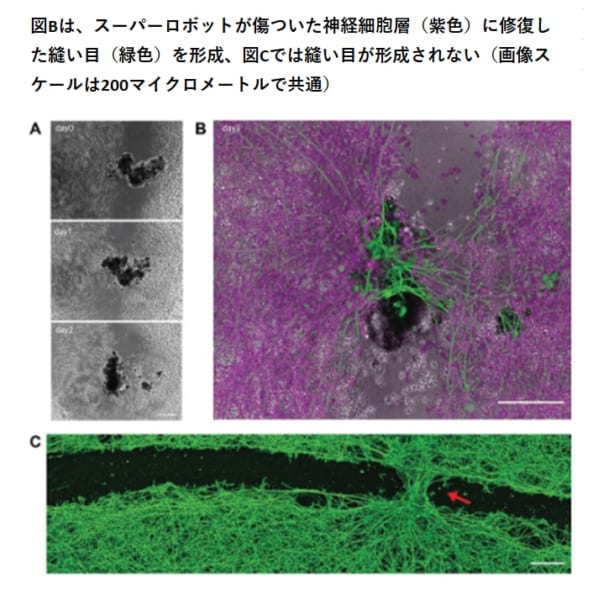
図Aは、スーパーロボットを配置した当日の様子ですが、上から、0日目、1日目、2日目で「橋」がつながった状態(黒っぽい部分)を示しています。
拡大した図Bでは、驚くべきことにスーパーロボットを傷の中に置いてから72時間以内に、元の組織の大幅な再生(すなわち、隙間を閉じること)が観察されました。
すなわち、「スーパーロボットの橋」のすぐ下に、傷の両側(紫色)をつなぐように「縫い目」(緑色)が形成されたのです。
但し、この隙間を閉じる現象は、スーパーロボットを配置した箇所でのみで確認され、そうでない箇所では長い傷全体を覆うような修復は見られませんでした(図C) 。
スーパーロボットが修復した傷部分の組織の密度については、元の回復状態に近いことを示しており、周囲の傷の部分とは明らかに異なっていました。
このことから、スーパーロボットが自律的に活動し、周囲の組織に対して修復や再生の能力を持っていることが明らかとなりました。
今後の展望
結果として、研究チームは前駆細胞が自己組織化し、自律的に運動する能力を持つアンスロボットの開発に成功しました。
これらのアンスロボットは、自己組織化のプロセスを経て、収縮性のある筋肉組織を形成し、収縮と弛緩を繰り返すことで自発的な運動を示しました。
特に驚くべきことは、外部からの刺激なしに、細胞が独自の力で運動を開始した点です。これは、細胞間の信号伝達が重要な役割を果たしていることを示しています。
研究者らは、アンスロボットが動脈硬化症患者の動脈内に蓄積した血栓の塊の除去や、呼吸系疾患の患者の気道からの過剰な粘液の除去、薬物の局所運搬などに利用できると考えているそうです。
また、この信号伝達のメカニズムを解明することで、今後さらに高度なバイオロボットの設計や、特定の機能を持たせることが可能になると考えています。
このように自己組織化し、運動するバイオロボットは、将来的に様々な分野での応用が期待されています。
この研究は非常に興味深い結果を示しましたが、まだ幾つかの課題も残されています。
まず、バイオロボットの持続性や長期的な機能維持については今後も継続的な確認を行い、実際の医療に応用する際には免疫反応や炎症を引き起こさないようにする工夫も必要です。
それでも、自ら動くバイオロボットが実現したということは、医療の未来にとって大きな希望です。
今後バイオロボットはどんな進化をとげるのか、目が離せません。
参考文献
Scientists build tiny biological robots from human cells
https://www.eurekalert.org/news-releases/1008859
ナノマシンがひらく新たな医療、早期発見、治療で健康を当たり前に(JSTnews June 2021)
https://www.jstage.jst.go.jp/article/jstnews/2021/6/2021_3/_pdf/-char/ja
元論文
Motile Living Biobots Self-Construct from Adult Human Somatic Progenitor Seed Cells
https://doi.org/10.1002/advs.202303575
ライター
鎌田信也: 大学院では海洋物理を専攻し、その後プラントの基本設計、熱流動解析等に携わってきました。自然科学から工業、医療関係まで広くアンテナを張って身近で役に立つ情報を発信していきます。
編集者
川勝康弘: ナゾロジー副編集長。
大学で研究生活を送ること10年と少し。
小説家としての活動履歴あり。
専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。
日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。
夢は最新科学をまとめて小学生用に本にすること。
