肝腫瘍に対する非侵襲的治療が、英国の革新的医療機器アクセス経路(IDAP)を通じて認定
ミネアポリス--(BUSINESS WIRE)--(ビジネスワイヤ) --ヒストソニックスは、肝腫瘍を非侵襲的に破壊する「エジソン・ヒストトリプシー・システム」が、未充足医療ニーズ認可(Unmet Clinical Need Authorisation:UCNA)の下、グレートブリテンにおいて規制枠内での限定的な早期市場アクセスを取得したことを明らかにしました。この認定は、英国のIDAPプログラムを通じて提供されるもので、特定の肝腫瘍患者に対し、ヒストトリプシーへの管理された早期アクセスを可能にします。これは、英国におけるがん治療で特に緊急性の高い未充足の医療ニーズのための新たな治療の選択肢を広げるうえで重要な節目となります。



IDAPプログラムは、変革的な医療技術を医療制度へ迅速に導入することを目的に英国政府が立ち上げたものです。同プログラムは、ヒストトリプシーが現在および将来の英国における最重要医療ニーズに有意義に対応する可能性を有していることから、2024年に選定されたわずか8件の申請枠の1つにエジソン・システムを抜擢しました。英国の医療機器規制機関である医薬品・医療製品規制庁(MHRA)は厳格な評価プロセスを経て、当社のヒストトリプシー機器がUCNAを通じて提供可能であると判断しました。これにより、原発性または転移性の肝腫瘍患者に対して、本機器がもたらす可能性のある重要な公衆衛生上の価値が強調されました。
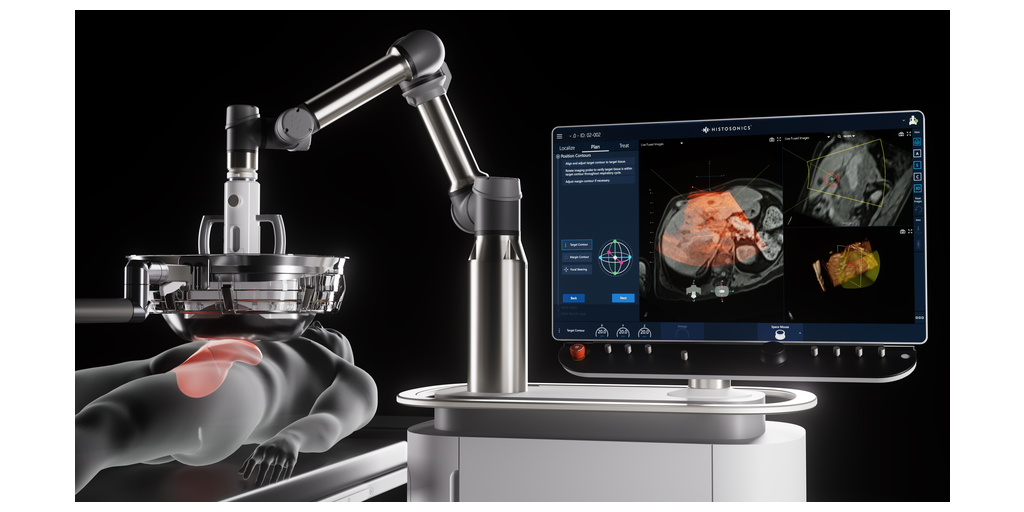
エジソン・システムは、非加熱・非侵襲の集束超音波技術であるヒストトリプシーにより、手術・放射線・全身療法を用いることなく腫瘍を機械的に液状化する、史上初かつ唯一のプラットフォームです。本機器は、2023年10月に米国食品医薬品局(FDA)よりデノボ(De Novo)認可を取得しました。ヒストソニックスのプラットフォームは、継続的なリアルタイム映像と制御を活用し、医師による腫瘍の破壊の計画・照準・治療・モニタリングを独自に可能にするもので、既存のいかなる治療法とも一線を画す、前例のない制御性と精密性を提供します。
「IDAPパイロット・プログラムを通じてグレートブリテンでの管理付きアクセスを確保できたことは、ヒストソニックスにとって極めて重要な節目であり、当社の技術が医療を変革し得る可能性が、明確に認められたことを示しています」と、ヒストソニックスの社長兼最高経営責任者(CEO)であるマイク・ブルーは述べました。「治療選択肢が限られている患者に対してヒストトリプシーを提供できるよう、NHSおよび英国の規制・アクセス関連機関と協力できることを光栄に思います。この進展は、米国における当社の確かな臨床実績および、世界的に拡大しつつある臨床エビデンスの蓄積に基づくものです。」
2023年10月にFDAのデノボ認可を取得した後、エジソン・システムは米国各地の主要な学術医療機関や病院で導入されています。また、統合型医療システムや地域病院などでも、革新的かつ非侵襲的な本治療法を患者へ提供することに関心が高まっており、導入が進められています。ヒストトリプシーの適応拡大に向けた追加の臨床試験も進行中であり、腎腫瘍を対象とした非侵襲的治療(HOPE4KIDNEY試験:NCT05820087)や膵腫瘍を対象とした非侵襲的治療(GANNON試験:NCT06282809)の臨床試験が、今後予定されている両適応の規制当局への申請に先立って実施されています。
同社は、過去数年間にわたり肝臓および腎臓を対象に実施してきた複数の先駆的な臨床試験を通じて英国国内で築き上げた強固な臨床的関係が、主要な英国医療機関におけるヒストトリプシーの導入を加速させることが期待されます。
UCNA認可の一環として、ヒストソニックスはMHRAと協力し、患者の転帰を評価するとともに、市販後監視プログラムの枠組みの中でデバイスの性能および安全性に関する実世界データを定期的に収集・分析していきます。ヒストソニックスは現在、欧州適合性評価(CEマーキング)プロセスを通じて欧州での規制承認の取得も進めており、英国および欧州全域での商業的な提供拡大が可能となる予定です。
英国向け適正使用目的文書:
エジソン・システムは、切除不能な肝腫瘍の一部または全部をヒストトリプシーにより非侵襲的に機械的破壊することを目的としています。これには、原発性肝がんに関連する悪性腫瘍および肝臓への転移性疾患の症例が含まれます。本機器は、ヒストソニックスが実施するトレーニングを修了した者のみが使用すべきであり、適切な訓練を受けた医師の臨床的判断に基づいて使用される必要があります。使用者は、本利用者ガイドを読み、警告事項、注意事項、報告された有害事象を含む臨床試験の概要について理解する必要があります。
エジソン・システムは、がんを含む特定の疾患の治療について評価されておらず、また、局所腫瘍の進行、5年生存率、全生存率など、特定のがんの転帰についても評価されていません。
米国向け適正使用目的文書:
エジソン・システムは、切除不能な肝腫瘍の一部または全部をヒストトリプシーにより非侵襲的に機械的破壊することを目的としています。FDAは、エジソン・システムによるがんを含むいかなる疾患の治療についても評価しておらず、局所腫瘍の進行、5年生存率、全生存率などの特定のがんの転帰についても評価していません。本システムは、ヒストソニックスが実施するトレーニングを修了した医師のみが使用すべきであり、適切な訓練を受けた医師の臨床的判断に基づいて使用される必要があります。警告事項、注意事項、報告された有害事象を含む臨床試験結果の概要については、本機器の使用説明書を参照してください。
ヒストソニックスについて
ヒストソニックスは非上場の医療機器会社で、集束超音波を使用して不要な組織や腫瘍を機械的に破壊し液化する新しい作用機序である組織破砕を活用した非侵襲プラットフォームと独自の音波ビーム療法の開発を行っています。同社は現在、米国および世界の一部の肝臓治療市場におけるEdison Systemの商品化に注力しており、同時に腎臓、膵臓などの他の臓器への組織破砕の適用範囲拡大に取り組んでいます。ヒストソニックスは米ミシガン州アナーバーとミネソタ州ミネアポリスにオフィスを構えています。Edison Histotripsy Systemについての詳細は、 www.histosonics.com/ をご覧ください。患者関連の情報については、 www.myhistotripsy.com/ をご覧ください。
「原発性および転移性肝腫瘍の組織破砕に関する#HOPE4LIVER単群ピボタル試験:臨床結果の1年間の最新情報」がジームレビッチらによって、CC BY-NC-NDライセンスのもと Annals of Surgery 誌に公開されています。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
For Media Inquiries
Media contact:
Josh King
Vice President of Marketing
Email : Joshua.king@histosonics.com
Phone : 608.332.8124
Kimberly Ha
KKH Advisors
917-291-5744
kimberly.ha@kkhadvisors.com
