大動脈弓病変の血管内治療専用にデザインされた初のデバイスを対象とした新しい臨床試験の患者組み入れを開始
米アリゾナ州フラッグスタッフ--(BUSINESS WIRE)--(ビジネスワイヤ) -- W. L. Gore &Associates, Inc.(ゴア)は本日、ピボタル試験でGORE® TAG®
Thoracic Branch
Endoprosthesis(TBE)の初の植え込みを発表しました。患者を組み入れたのは、ミシガン大学フランケル心血管センター成人心臓外科科長で米国の共同治験責任医師を務めたヒマンシュ・パテル医師(MD)です。
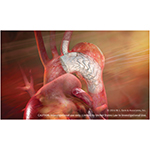

本試験の目的は解離、外傷、動脈瘤を含め、大動脈弓および胸部下行大動脈の病変治療でTBEの安全性と有効性を検討することです。本ピボタル試験は、分岐型デバイスを腕頭動脈(BCA)または左総頚動脈(LCC)に留置するZone
0~1での早期実現可能性試験と、分岐型デバイスを左鎖骨下動脈(LSA)に留置するZone
2での実現可能性試験の両方に続いて実施されるものです。本ピボタル試験には全米の最大40カ所の施設が参加し、最大435人の患者を組み入れる予定で、Zone
0~2の近位部へのグラフト留置を必要とするあらゆる病因に対処します。
パテル医師は次のように述べています。「TBEは市販のデバイスとして、これまで切開手術と血管内処置の両方が困難であった大動脈弓疾患を持つ患者に、新しい低侵襲治療の選択肢となります。GORE®
TAG®
Deviceの血管追従性は、独自の側枝デザインと相まって、腕頭動脈・左総頚動脈・左鎖骨下動脈の灌流の機会を伴う大動脈弓の低侵襲療法を提供します。」
大動脈弓の疾患はこれまで治療が困難でした。これらの病変に現在取り得る選択肢は、切開手術のような複雑な処置、外科的血行再建術を伴うハイブリッドアプローチ、またはデバイスを適応外使用する複合的な処置を必要とします。これら患者に対する選択肢が限られていることが一因となり、TBEはゴアのデバイスとして初めてFDAの迅速アクセスパスウェイ(EAP)の指定を受け、また米国でこの指定を最初に受けた医療機器の1つとなっています。EAP指定は、生命を脅かす疾患についての未充足医療ニーズに対応し、既存の他の選択肢と比べて意義のある利益を患者に提供できる可能性を実証する一定の医療機器のみに与えられるものです。
米国の共同治験責任医師を務めたマイケル・デーク医師(MD、スタンフォード大学)は、次のように述べています。「私たちは、実現可能性試験と早期実現可能性試験での成功に基づき、この革新的なデバイスを使用して広範囲の患者を治療するという、次の段階としての今回の有意義な試験に大いに期待しています。」
長期耐久性を持つように設計されたGORE TAG Thoracic Branch
Endoprosthesisは、既製の大動脈分枝用デバイスとして初めてピボタル試験で検討されます。1本の弓部血管への灌流をもたらすように設計された大動脈用と側枝用の両コンポーネントを備えたこのカニューレ装着済みデバイスは、血管分岐被覆のリスクを最小限に抑え、植え込みの容易性を向上させるよう設計されています。側枝用コンポーネントもゴアのCBAS
Heparin Surfaceを備えていますが、これは血栓形成に抗するようにデザインした実証済みの持久性ヘパリン結合技術です。
ゴアの大動脈関連事業部門リーダーを務めるライアン・タケウチは、次のように述べています。「当社は市場で最も広範な血管内治療機能を提供すべく一貫して努力しており、TBEのピボタル試験で初の植え込みはこうした取り組みで最近果たした前進です。このデバイスのファミリーで多くの『初』を生み出してきた伝統を踏襲し、当社はこの治療法を初めてピボタル段階に進め、困難な大動脈弓の病変を既製の血管内デバイスで治療できるようにします。」
TBEは拡大を続ける当社の血管内治療製品ファミリーの一角を占めるものであり、本ファミリーの共通の目的はゴアの高く評価されている臨床サポートチームと教育サービスの支えによって大動脈疾患を効果的に治療することです。当社の包括的製品ポートフォリオには、そのまま即使用できる腸骨枝デバイスとして初めてFDAから承認され、総腸骨動脈瘤と大動脈腸骨動脈瘤の血管内治療が適応となるGORE®
EXCLUDER® Iliac Branch
Endoprosthesis(IBE)が含まれます。分岐型ポートフォリオを完成させるため、GORE® EXCLUDER®
Thoracoabdominal Branch Device(TAMBE)についての研究を米国とブラジルで実施中です。
W. L. Gore &Associatesについて
ゴアは40年にわたり、医療上の複雑な問題に対する創造的な治療ソリューションを提供してきました。その間に世界各国で4000万個を超えるゴアの革新的な医療デバイスが植え込まれ、患者の命を救い、生活の質を向上させています。当社の広範な製品ファミリーには血管グラフト、血管内治療・インターベンション治療用デバイス、ヘルニア/軟部組織再建用外科メッシュ、ステープルライン補強材、血管/心臓/一般外科手術で使用する縫合糸が含まれます。当社は米国の「最も働きがいのある企業トップ100社(100
Best Companies to Work
For)」の諸ランキングが1984年に最初に発表されて以来、すべてに掲載されてきた数少ないえり抜き企業の1つです。
掲載製品は全市場で提供できるとは限りません。
CBASはW. L. Gore &Associates,
Inc.の完全子会社Carmeda ABの商標です。
GORE®、EXCLUDER®、TAG®と各デザインはW. L. Gore &
Associatesの商標です。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
Chempetitive Group for W.L. Gore &Associates
Andrea Vuturo,
+1-858-457-2436
GoreMedical@Chempetitive.com
